농도의 단위 중에서
다른 농도 단위들에 비해 사용 빈도가
낮긴 하지만
그래도 그 용도가 명확한 농도 단위가 있다.
바로 몰랄농도(molality) 이다.
몰랄농도(molality)는 몰농도(molarity)와 다른 개념이며
구분해서 사용해야 한다.
농도의 단위 중에 하나인 몰랄 농도의 뜻을 이해하고
사용법과 농도 간의 전환되는 계산법을 알아보자.

1. 몰랄농도(molality) 는 무엇인가?
1-1. 몰랄농도는 용매 1 kg 당 용질의 몰수로 정의한다.

1-2. 몰랄농도의 단위는 m 이며,
읽는 방법은 molality(미국∙영국[moulǽliti] / 몰래리디) 이다.
※ 몰농도(molarity)는 단위는 M이며,
읽을 때는 molarity(미국∙영국[moulǽrəti] / 몰래러디) 이다.
3. 몰랄농도는 무게비를 사용하기 때문에 온도와 무관하다.
4. 묽은 수용액에서는 물 1 L 당 용질의 몰수와 물 1 kg 당 용질의 몰수는 거의 같다.
따라서, 몰농도와 몰랄농도는 거의 같다.
그러나 비수용액 & 진한 수용액에서는 맞지 않는다.
[문제 1]
1) 물 0.200 L에 MgCl2 22.4 g 을 녹여 용액을 만들었다.
MgCl2 용액의 밀도는 1.09 g/cm3 ,
순수한 물의 밀도는 1.00 g/cm3 이다.
이 용액의 몰농도와 몰랄농도를 구하라.
(MgCl2의 몰질량 : 95.22 g/mol )
[풀이 과정]
1. 몰농도(molarity) 구하기
(1 단계 ) 몰수 구하기

이 용액의 몰수는 0.235 mol 이다.
(2 단계 ) 용액의 부피 구하기
몰농도를 계산하기 위해서는 용액의 부피를 계산.
용액의 질량은
물 0.200 L 는 0.200 kg = 200 g 이다.
이것은 물의 밀도가 1 g/cm3 이므로 물 1 g = 1 ml 가 성립된다.
용질의 질량은 MgCl2가 22.4 g 이다.
물 200 g + MgCl2 22.4 = 222.4 g 이다.
즉, 이 용액의 질량은 222.4 g 이다.
용액의 부피는 주어진 용액의 밀도를 적용하여 계산한다.

1 cm3 = 1 ml 이고,
1,000 ml = 1 L 이다.
이 용액의 부피는 0.204 L 이다.
(3 단계 ) 몰농도 구하기
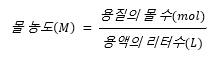
위에서 구한 용질의 몰수와 용액의 부피를 적용하면

MgCl2의 몰농도는 1.15 M 이다.
2. 몰랄농도(molality) 구하기

위에서 몰농도를 계산할 때,
MgCl2 의 용질의 몰수(0.235 mol)는 알고 있다.
이 용액의 용매 무게는 ?
(★몰랄농도는 용액의 무게가 아니다.★)
물 200 g + MgCl2 22.4 = 222.4 g 이 값이 아니라는 것이다.
용매인 물의 부피 0.200 L = 용매인 물의 질량 0.200 kg

MgCl2의 몰랄농도는 1.18 m 이다.
[문제 2]
1) 0.8585 M 황산 수용액의 밀도가 1.4094 g/cm3 이다.
이 용액에서 황산의 몰랄농도, 질량퍼센트을 계산하라.
(H2SO4 의 몰질량 : 98.08 g/mol )
[풀이 과정]
1. 몰랄농도(molarity) 구하기

(1 단계 ) 몰수 구하기
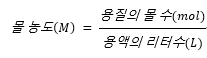
주어진 황산 용액의 몰농도(M)는 0.8585 M 이다.
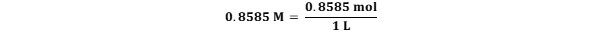
황산 수용액에서 용질의 몰수는 0.8585 mol 이다.
(2 단계 ) 용매의 질량 구하기
황산 수용액 1 L 질량은 밀도값이 주어졌기 때문에 알 수 있다.
1 L = 1,000 ml = 1,000 cm3
1 kg = 1,000 g
따라서 용액 1 L의 질량은

즉, 0.8585 M 황산 수용액의 1 L 의 질량은 1.4094 kg 이다.
이 용액에서 용매 질량을 구하기 위해서는
1 L 인 황산 수용액(황산+물)의 무게에서 황산의 무게를 빼면 된다.
황산의 무게를 구하면,
이 용액 1L 에는 황산 0.8585 mol 이 들어있으므로
주어진 몰질량을 적용하여 질량을 계산하면 다음과 같다.

즉, 황산 수용액 1L 에는 황산이 84.20 g 들어 있다.
0.8585 M(mol/L) 황산 수용액은 1L 에 황산 84.20 g 있으므로
0.8585 M(mol/L) 황산 수용액의 1L 의 질량인 1.4094 kg 에서
이 용액에 들어 있는 황산 84.20 g 빼면
황산 수용액 1L 에 들어 있는 물(=용매)의 질량이 된다.
84.20 g 을 kg으로 전환하면
1 kg = 1,000 g

84.20 g = 0.0842 kg
황산수용액 = 물 +황산
물(=용매)의 질량 = 1.4094 kg (황산수용액(1 L)의 질량) - 0.0842 kg(황산 질량)
= 1.3252 kg

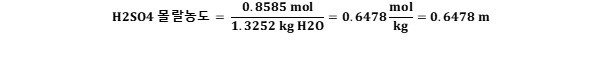
※ 정답 : 0.8585 M(몰농도)인 황산 수용액의 몰랄농도(m)는 0.6478 m 이다.
2. 질량퍼센트 구하기

위에서 이미 모든 값을 계산했다.
따라서 이 식에 적용만 하면 된다.
[ 황산수용액의 질량 ? ]
용액 1 L의 질량은

[ 황산의 질량은 ? ]
이 용액 1L 에는 황산 0.8585 mol 이 들어있으므로
주어진 몰질량을 적용하여 질량을 계산하면 다음과 같다.


따라서
질량퍼센트를 계산하면

※ 정답 : 0.8585 M(몰농도)인 황산 수용액의 질량퍼센트는 5.974 % 이다.
문제 풀이를 자세히 제시한 이유는
계산 과정에 있어 환산 인자 적용 및 농도 개념이
불분명하여 오류를 범하기 쉽기 때문이다.
위의 풀이 과정을 참고하여 계산법에 익숙해지도록 하자.
방문 감사드립니다.
공감/댓글은 제작에 힘이 됩니다. ^^
Written by K-Lab Zone (K-LZ)
2021.12.19 - [배워보자/과학(Science)] - [과학] 완전 쉽게 설명하는 과학 이야기 - 몰농도
[과학] 완전 쉽게 설명하는 과학 이야기 - 몰농도
[ 몰 농도(molarity, M) ] 일반적으로 화학 반응에서의 계산을 하기 위해서는 몰수를 알아야 하기 때문에 용액의 농도를 표시하는 수단으로 사용된다. 용액 1 L (liter)에 용해된 물질(용질)의 몰수이다
yobebe.tistory.com
2021.12.19 - [배워보자/과학(Science)] - [과학] 완전 쉽게 설명하는 과학 이야기 – 몰(mole)
[과학] 완전 쉽게 설명하는 과학 이야기 – 몰(mole)
몰(mole) 화학양론에서 주로 거론되는 단위이다. 물질의 화학량을 측정하는 단위이고, 약자는 mol이라고 부른다. mole 는 라틴어 ‘더미’라는 의미이다. 연필 한 다스(dozen)는 12개 이와 같이 물건의
yobebe.tistory.com
'배워보자 > 화학 강의(Chemistry Course)' 카테고리의 다른 글
| [화학 강의]4. 유기화학원론/일반화학 - 양전하, 음전하, 형식전하 계산, 루이스 구조식 그리는 법, 공유결합 내의 형식전하, 비공유전자쌍 형식전하 (0) | 2023.07.30 |
|---|---|
| [화학 강의] 3. 유기화학원론_일반화학- 공유결합, 결합에너지, 팔전자규칙, 루이스 구조식, 루이스 모델, 이중결합, 삼중결합, 극성 공유결합, 전기음성도, 이중극자모멘트 (0) | 2023.07.26 |
| [화학 강의] 완전 쉽게 설명하는 화학 이야기 – 용액, 용매, 용질 무엇인가? (0) | 2023.07.02 |
| [화학 강의] 완전 쉽게 설명하는 화학 이야기 – 유효숫자 갯수 표기 방법 (0) | 2023.07.02 |
| [화학 강의] 완전 쉽게 설명하는 화학 이야기 - 농도의단위 : ppm을 % 단위로 변환 (0) | 2023.07.02 |