몰(mole) 화학양론에서 주로 거론되는 단위이다.
물질의 화학량을 측정하는 단위이고, 약자는 mol이라고 부른다.
mole 는 라틴어 ‘더미’라는 의미이다.
연필 한 다스(dozen)는 12개
이와 같이 물건의 묶음 단위를 표현하는 것처럼
눈에 보이지 않는 화학 세계에선 화학 반응에 참여하는 수 많은 물질, 분자나 이온을 숫자를
묶음 단위로 표현하기 쉽게 특별한 단위를 사용하는 것이다.
이것이 바로 몰(mole)이라는 단위이다.
이 단위는 6.022 x 1023 개이고, 이 수를 아보가드로 수(Avogradro’s number, NA)라고 한다.
풀어서 서술하면 6.022 X 100,000,000,000,000,000,000 개 (= 602,200,000,000,000,000 개)이다.
일상 생활에서는 가늠하기도 힘든 수이지만,
화학 세계에서 화학 반응을 표현하기 위한 기본 표현 방법으로 사용된다.
[ 1 mol 의 표현 예시 ]
1 mol 축구공 = 6.022 x 1023 개의 축구공
1 mol 골프공 = 6.022 x 1023 개의 골프공
1 mol HCl(염산) = 6.022 x 1023 개의 HCl(염산)
1 mol Na+ 이온 = 6.022 x 1023 개의 Na+ 이온
그러면 왜 mol과 아보가드로 수가 화학에서 중요할까?
이것은 분자의 수와 분자의 질량 사이의 관계 때문이다.
어떤 원소의 원자 1몰의 질량은 그 값이 수치적으로 그 원소의 단위가 없는 상대원자량과 같다.
몰질량(molar mass)의 단위는 grams per mole = g/mol 이다.
물질 1 mol은 분자량이나 화학식량과 같은 질량을 그램(g) 단위로 갖는다.
이 표현들이 어떤 뜻인지 아래 예시를 보자.
HCl 분자량 = 36.5 , HCl 의 몰질량 = 36.5 g ( 6.022 x 1023 개)
→ HCl 1 mol 은 36.5g
→ HCl의 몰질량은 36.5 g/mol (=HCl 1mol 당 36.5 g의 질량을 갖는다 라는 의미)
→ HCl 1 mol의 분자 수 = 1 mol x (6.022 x 1023 mol-1) = 6.022 x 1023 개
NaCl 분자량 = 58.5 , HCl 의 몰질량 = 58.5 g ( 6.022 x 1023 개)
→ NaCl 1mol 은 58.5g
→ NaCl의 몰질량은 58.5 g/mol (=NaCl 1mol 당 58.5 g의 질량을 갖는다 라는 의미)
→ NaCl 1 mol의 분자 수 = 1 mol x (6.022 x 1023 mol-1) = 6.022 x 1023 개
H2O 분자량 = 18.0 , HCl 의 몰질량 = 18.0 g ( 6.022 x 1023 개)
→ H2O 1mol 은 18.0g
→ H2O의 몰질량은 18.0 g/mol (=H2O 1mol 당 18.0 g의 질량을 갖는다 라는 의미)
→ H2O 1 mol의 분자 수 = 1 mol x (6.022 x 1023 mol-1) = 6.022 x 1023 개
화학 실험을 할 때,
반응물의 분자를 셀 수 없지만, 정확한 개수를 갖도록 무게를 달아야(칭량) 한다.
즉, 갯수비를 질량비로 바꾸어야 한다.
분자의 수와 질량 사이의 변환 인자(conversion factor)로서 몰질량이 사용된다.
[예시]
0.50 mol의 물이 화학반응에서 필요하다고 하자. 물을 몇 그램(g) 취해야 하는가?
→ 0.5 mol 해당하는 물의 질량을 알아내라는 뜻이다.
물의 몰질량은 = 18.0 g/mol 이다.
변환 인자를 사용해서 계산식을 사용하면 아래와 같다.
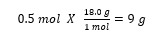
즉, 저울로 물을 9 g 을 취하면 0.5 mol 해당하는 것이다.
몰질량은 물질의 질량과 몰 단위의 물질의 화학량 사이의 환산인자가 되는 것이다.
중요한 점은 화학 반응식에서는 몰(분자의 수)이 사용되지만,
실험실에서는 반응물의 무게를 재는 데에는 그램(g)이 사용된다는 것이다.
몰은 얼마나 많은 개수의 반응물이 필요한지를 말해주며,
그램은 얼마나 많은 질량의 반응물이 필요한지를 말해주는 것이다.
몰 : 분자의 수 또는 화학실 단위의 수
그램 : 반응물의 질량
한 반응물의 그램 수로부터 또 다른 반응물의 그램 수로 직접 갈 수 없다는 뜻이다.
화학 반응 실험을 진행할 때에는 사용하는 시약의 질량을 우선 mol 로 변환시켜야 한다.
몰질량을 변환 인자로서 사용해서 필요없는 단위가 없어지도록 식을 세워서 계산한다.
그램(g) ⇒ mol ⇒ 계산
이것이 화학 실험의 시작 단계인 것이다.
방문 감사드립니다.
공감/댓글은 저에게 힘이 됩니다.
신기방기 과학교실
Written by Chang-Ho, Yoon. / K-Lab Zone (K-LZ)
2021.12.19 - [배워보자/과학(Science)] - [과학] 완전 쉽게 설명하는 과학 이야기 - 몰농도
[과학] 완전 쉽게 설명하는 과학 이야기 - 몰농도
[ 몰 농도(molarity, M) ] 일반적으로 화학 반응에서의 계산을 하기 위해서는 몰수를 알아야 하기 때문에 용액의 농도를 표시하는 수단으로 사용된다. 용액 1 L (liter)에 용해된 물질(용질)의 몰수이
yobebe.tistory.com
'배워보자 > 화학 강의(Chemistry Course)' 카테고리의 다른 글
| [화학 강의] 1. 유기화학 원론_원자,전자,오비탈 (1) | 2023.06.19 |
|---|---|
| [화학 강의] 완전 쉽게 설명하는 화학 이야기 – 농도희석 (0) | 2021.12.28 |
| [화학 강의] 완전 쉽게 설명하는 화학 이야기 – 농도환산 (0) | 2021.12.27 |
| [화학 강의] 완전 쉽게 설명하는 화학 이야기 - 몰농도 (0) | 2021.12.19 |
| [화학 강의] 완전 쉽게 설명하는 화학 이야기 - 단위 환산 (0) | 2021.12.13 |