Ⅰ. 농도(concetration) 란?
설탕물에 설탕이 얼마나 있지? / 소금물에 소금은 얼마나 있지?
소주에는 알코올이 얼마나 포함되어 있을까?
이처럼 일상 생활에서 농도를 표시하거나 표현하는 말은 쉽게 찾아 볼 수 있다.
이와 같이 전체에서 거기에 포함된 일부를 표현하는 방법으로 농도를 사용한다.
즉, '일부'라는 개념에 포커스를 맞춘 것으로 "어디에 무엇이 얼마 (들어)있다."를 알고자 함이다.
실험에서는 분석 대상 물질을 제외한 나머지 혼합물을 매트릭스라고 하며,
이것은 분석 시료에서 분석물(알고자 하는 물질 & 알고 싶어하는 물질)을 제외한 모든 물질을 말한다.

위의 경우처럼 농도는 다양한 표현으로 사용될 수 있다.
분모를 규정하는 양의 단위와 분자를 규정하는 양의 단위가 여러가지로 표현될 수 있다는 것이다.
분자를 이루는 용질, 혹은 분석 대상 물질은 어떻게 표시하는냐??
일반적으로 g , ml , mol 로 표시한다.
1. 그램(g)으로 표현하는 질량 단위
2. 밀리리터(ml)로 표현하는 부피 단위
3. mol 개념이 포함된 몰농도
[ 몰농도는 이전에 설명한 자료를 참고하세요 - 이 글 맨 아래 링크했습니다. ]
여기서 mol은 분자나 원자의 개수를 세는 단위로 mol은 농도 단위가 아니다.
mol ≠ M(몰농도)
1 mol = 6.022 X 1023 개이며
1 mol = 1g molecular weight ( g을 붙인것이 1mol에 해당하는 양이라는 뜻)
g 원자량 또는 g 분자량이라고 한다.
이와 같이 분자와 분모의 양을 알면 농도의 종류가 정해진다.
Ⅱ. 퍼센트 농도(%)
%(w/w) = (g/g) x 100
%(v/v) (ml/ml)x 100
%(w/v) (g/ml) x 100
%(w/v) (g/ml) x 100 은 물을 기준으로 1기압 4℃에서 물 1g의 부피는 1ml이기에 표현할 수 있는 방법이다.
만약 1% 라고 표시하면 아래와 같이 여러 단위로 사용 가능하다.
1%(w/w)=1g/100g=0.01(g/g) X 100
1%(v/v)= 1ml/100ml=0.01(ml/ml) X 100
1%(w/v)=1g/100ml=0.01(g/ml) X 100
화학 실험에서는 %(w/v)을 주로 사용한다.
Ⅲ. ppm (ppm, par per million) 농도
백만분의 1
%(w/w) = (g/g) x 10-6
%(v/v) (ml/ml) x 10-6
%(w/v) (g/lm) x 10-6
1ppm=1ug/g
= 1mg/kg 주로 사용
=1g/Mg
= 1mg/L
=1ug/Ml
참고 m=10-6, M=106
Ⅳ. ppb (ppb, par per billion) 농도
1 억분의 1
%(w/w) = (g/g) x 10-9
%(v/v) (ml/ml) x 10-9
%(w/v) (g/ml) x 10-9
Ⅴ. molarity(M, 몰랄농도)
molality(m)=1 mol ÷ kg solvent
Ⅵ. 기타 농도 표기 방법
◎ mol fraction
⇒ mol fraction = mol(분석대상 관심대상) ÷ mol(전체)
◎ mol %
⇒ mol % = (mol(분석대상 관심대상) ÷ mol(전체)) x 100
문제를 통해 개념을 이해 해 보자!!
이것만 알면 모든 농도 환산 문제를 풀 수 있다.
1. 분수 설정 (Fraction unit)
2. 환산 인자 적용
⇒ 원하는 농도가 나오는 단위가 나올 때가지 환산인자 사용
문제 1)
2.5%(w/v) NaCl(F.W 58.4)의 M은?
⇒ 2.5%의 NaCl은 몰농도(M)로 얼마인가?
주어진 %(w/v)농도를 몰농도(mol/L)로 단위 변환해서 계산하면 된다.
풀이)
g ⇒ mol
ml ⇒ L
분자량( F.W)으로 주어진 값 : 1mol=58.44g NaCl
2.5g NaCl/100ml soln.
⇒ 100ml 용액에 2.5g NaCl 이 들어있는 소금(NaCl)의 몰농도는?

문제 2)
0.054M MgCl2 용액이 25ml에 있는 MgCl2이 몇 g이 있나? (MgCl2 F.W=95.21)


용액 1 L 의 단위 환산 인자로 25ml x 40 ml = 1000 ml 으로 표현.
⇒ 0.054M MgCl2 용액이 25ml에는 MgCl2 이 0.13g이 들어 있다.
문제 3)
37%(w/w) HCl soln. 몰농도(M)? (HCl F.W=36.46 , 37% HCl 밀도 = 1.19g/ml)
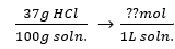
분자 g ⇒ mol
분모 g ⇒ ml ⇒ L (밀도 알아야 함)

방문 감사드립니다.
공감/댓글은 저에게 힘이 됩니다.
신기방기 과학교실
Written by Chang-Ho, Yoon. / K-Lab Zone (K-LZ)
[과학] 완전 쉽게 설명하는 과학 이야기 - 몰농도
[ 몰 농도(molarity, M) ] 일반적으로 화학 반응에서의 계산을 하기 위해서는 몰수를 알아야 하기 때문에 용액의 농도를 표시하는 수단으로 사용된다. 용액 1 L (liter)에 용해된 물질(용질)의 몰수이
yobebe.tistory.com
[과학] 완전 쉽게 설명하는 과학 이야기 – 몰(mole)
몰(mole) 화학양론에서 주로 거론되는 단위이다. 물질의 화학량을 측정하는 단위이고, 약자는 mol이라고 부른다. mole 는 라틴어 ‘더미’라는 의미이다. 연필 한 다스(dozen)는 12개 이와 같이 물건의
yobebe.tistory.com
'배워보자 > 화학 강의(Chemistry Course)' 카테고리의 다른 글
| [화학 강의] 1. 유기화학 원론_원자,전자,오비탈 (1) | 2023.06.19 |
|---|---|
| [화학 강의] 완전 쉽게 설명하는 화학 이야기 – 농도희석 (0) | 2021.12.28 |
| [화학 강의] 완전 쉽게 설명하는 화학 이야기 - 몰농도 (0) | 2021.12.19 |
| [화학 강의] 완전 쉽게 설명하는 화학 이야기 – 몰(mole) (0) | 2021.12.19 |
| [화학 강의] 완전 쉽게 설명하는 화학 이야기 - 단위 환산 (0) | 2021.12.13 |