
[화학 간단 정리]
1. 화학 강의_일반화학, 유기화학 기초 과정_원자,전자,오비탈
프롤로그(Prologue)
화학을 이해하기 위해서는 화학 구조를 알아야 한다.
어떤 물질의 성질은 그 물질을 이루고 있는 원자와
그 원자들이 어떻게 결합되어 있는지에 따라 달라진다.
유기화합물의 구조와 성질의 상관 관계를 이해하기 위해서 그 기본 구조부터 알아보자.
1. 원자
1-1. 원자의 성질은 원자의 구조에 따라 결정!!
1-2. 원자의 구성 입자 중 양성자의 수가 원소의 성질에 가장 큰 영향을 준다.
1-3. 각 원소는 그 원소의 핵에 들어 있는 양성자의 수와 같은 수의 원자번호를 갖는다.
원자번호(atomic number, Z) = 원소가 가지는 양성자 수
ex.) 탄소 원자 = 양성자 6 = 원소 번호 6
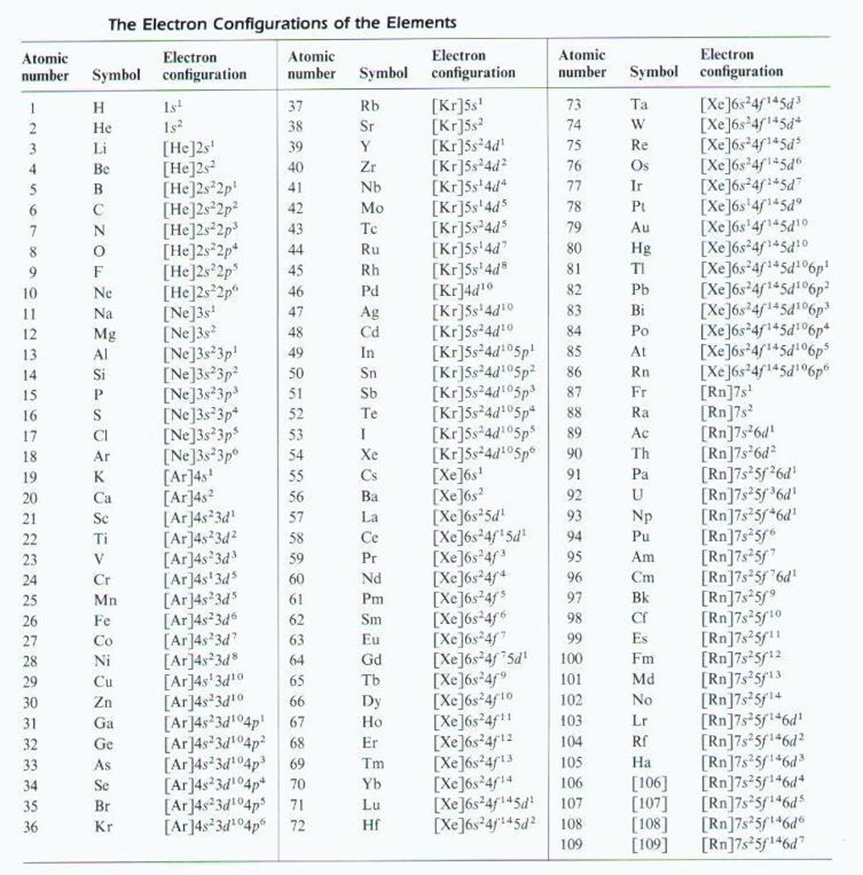
1-4. 원자(atomic) 구성 = 원자핵(양성자+중성자) + 전자
2. 오비탈(orbital)
2-1. 원소의 모든 양성자는 핵 내에 존재.
2-2. 원소의 전자들은 핵 주위의 여러 에너지 준위에 있는 오비탈에 분포.
2-3. 원자의 행동을 알고 싶으면 그 전자 배치를 봐야한다.
2-4. 슈뢰딩거(schrodinger) – 전자를 파(wave)로 취급하여 방정식 고안.
- 양성자, 중성자를 다룬 식이 아니다!!!
- 수소 원자의 전자 에너지 계산 → 일련의 에너지 준위(energy levels) 계산.
- 에너지 준위 = 전자파의 수학적 표현
→ 파동함수(wave function)라고 부름.
→ 그리스 문자 ψ(psi) ‘크사이’ 로 표현
2-5. Heisenberg(하이젠베르그)의 불확정성 원리
- 전자가 어디에 있는지 정확히 모름. 단, 어디쯤 있을 것이라고 말함.
- 원자 핵 주위에서 어떤 지점에서 전자를 발견할 확률은 ψ2. (파동함수의 제곱)
- 전자를 발견할 확률은 핵 주위에서 제일 높고
- 핵에서 멀어질수록 줄어들지만 0이 되지 않음.
2-6. 오비탈
- 에너지 준위 = 파동함수 = 오비탈
- 오비탈 : 크기(에너지), 모양, 방향성을 나타냄.
2-7. 주 양자수(principal quantum number)
- 오비탈의 에너지와 관계 있는 껍질(shell)에 해당. n=1,2,3
- 대칭 구형 모양 = s 오비탈
- 주양자수 표현 방법 – s 오비탈 앞에 n=1,2,3 등을 표기
ex.) 1s, 2s,..
- 1s 오비탈에 있는 전자는 2s 오비탈에 있는 전자보다 핵과 더 가까이 있다.
- 더 낮은 에너지를 갖고, 핵에 더 강하게 묶여 있다는 뜻!!
- 표현 방법
수소 원자(Z=1)는 전자 하나를 가진다. 수소 : 1s1
헬륨 원자(Z=2)는 전자 두개를 가진다. 헬륨 : 1s2
2-8. 스핀 양자수(spin quantum number)
- 전자는 음전하, 스핀(spin) 가지고 있음.
- 스핀 양자수는 +1/2, -1/2 존재.
2-9. 파울리의 베타 원리(Pauli exclusion principle)
- 두 개의 전자는 스핀이 서로 반대이거나
‘쌍’을 이룰 때 같은 오비탈에 들어갈 수 있다.
- 즉, 오비탈은 두 개 이상의 전자를 가질 수 없다는 뜻!!
2-10. 주기율표 상의 주기(period)는 전자가 채워진 가장 높은 오비탈의 주양자수와 같다.
ex.) 수소(H), 헬륨(He) =>→ 1 주기 ▶ 주기율표의 가로를 기준으로 표현.
Li 리튬(Z=3)의 전자 배치 : 1s2 2s1 / 2주기
Be 베릴륨(Z=4)의 전자 배치 : 1s2 2s2 / 2주기
- 두 개의 전자가 1s 오비탈에 들어가기 때문에 세 번째 전자는
더 높은 에너지의 오비탈에 들어감.
- 1s 다음에 높은 에너지의 오비탈은 2s이다.
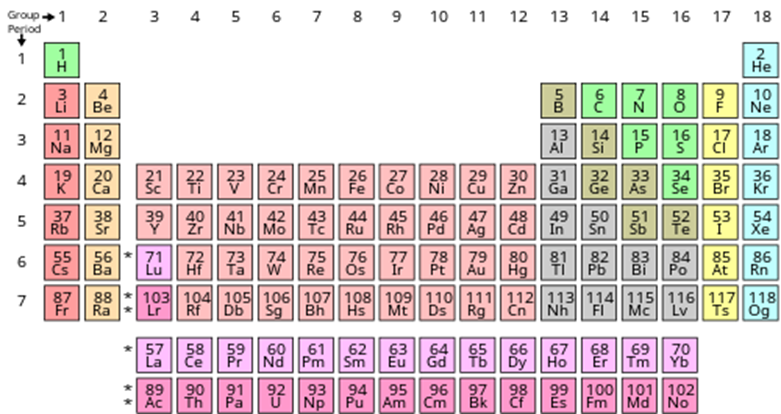
2-11. p 오비탈
- 원자번호 5번부터는 2s가 채워진 다음에 p 오비탈에 채워진다.
ex.) B 보론(Z=5)의 전자 배치 : 1s2 2s2 2p1
- p오비탈은 2px, 2py, 2pz의 세 오비탈 구성되며, 에너지가 모두 같다.
- 아령 모양이며, 파동 함수의 부호가 바뀜.
- 전자를 발견할 수 있는 확률이 0인 마디면(nodal surface)으로 분리
ex.)
2px는 x축 기준으로 아령 모양으로 분리된 모양이며, 2px 오비탈의 마디면은 yz-평면
2py는 y축 기준으로 아령 모양으로 분리된 모양이며, 2py 오비탈의 마디면은 xz-평면
2px는 x축 기준으로 아령 모양으로 분리된 모양이며, 2pz 오비탈의 마디면은 xy-평면
2-12. 훈트의 법칙(Hund’s rule)
- 에너지가 같은 오비탈에 대한 일반적인 규칙.
- 2p 오비탈을 채울 때에는 두 개의 전자를 채우기 전에 각각 하나씩 먼저 채워야 한다.
2-13. 원자가 전자(valence electron)
- 화학 결합과 반응에 참여하는 최외각의 전자들.
- 두 번째 주기의 원소들의 최외각 전자는 2s, 2p.
즉, 2s, 2px, 2py, 2pz 이므로 4개의 오비탈이 관여하기 때문에
- 2번째 주기들의 원소들의 최외각 전자의 최대수는 8개!!!!!
- 최외각 원자를 원자가 껍질(valence shell)로 표현.
- 2s, 2p 오비탈이 채워지면 다음 단계인 3s, 3px, 3py, 3pz에 채워진다.
- 3s, 3p는 2s, 2p 오비탈에 있는 전자보다 핵에서 더 멀리 떨어져 있고
더 높은 에너지를 가지고 있다.
2-14. 팔전자계(octet)
- 2주기 네온(Ne, Z=10), 3주기 아르곤(Ar, Z=18)은 원자가 껍질에 8개 전자를 가짐.
- 완전한 팔전자계를 가졌다고 표현한다.
- 헬륨, 네온, 아르곤은 영족 기체(noble gas) 또는 희귀 기체(rare gas)
- 영족 기체 특징 : 안정한 전자 배치(8개) 가지며, 반응성이 거의 없음.
방문 감사드립니다.
Written by K-Lab Zone (K-LZ)
2023.06.23 - [배워보자/화학 강의(Chemistry Course)] - [화학 강의] 2. 일반화학, 유기화학 기초과정_이온결합
[화학 강의] 2. 일반화학, 유기화학 기초과정_이온결합
[화학 간단 정리] 2. 화학 강의_일반화학, 유기화학 기초과정_이온결합 프롤로그(Prologue) 원자는 서로 결합하여 원자와는 다른 성질을 가진 화합물(compound)을 형성. 화합물에서 원자 사이의 끄는
yobebe.tistory.com
'배워보자 > 화학 강의(Chemistry Course)' 카테고리의 다른 글
| [화학 강의] 완전 쉽게 설명하는 화학 이야기 - 농도의단위 : ppm 과 ppb 의미 사용 및 계산법 (0) | 2023.07.02 |
|---|---|
| [화학 강의] 2. 유기화학 원론_일반화학, 유기화학 기초과정_이온결합 (1) | 2023.06.23 |
| [화학 강의] 완전 쉽게 설명하는 화학 이야기 – 농도희석 (0) | 2021.12.28 |
| [화학 강의] 완전 쉽게 설명하는 화학 이야기 – 농도환산 (0) | 2021.12.27 |
| [화학 강의] 완전 쉽게 설명하는 화학 이야기 - 몰농도 (0) | 2021.12.19 |